Elektrochemie
Erfahre mehr über die Themen Elektrolyse, Abscheidungspotential, Redoxpotential und galvanisches Element
Die Elektrochemie untersucht, wie Elektrizität Stoffe verändern kann und wie chemische Reaktionen Strom erzeugen können. In der Elektrochemie geht es oft um Batterien, die Strom speichern, und Elektrolyse, bei der Wasser in Sauerstoff und Wasserstoff getrennt wird.
Die Elektrolyse
Bei der Elektrolyse wird elektrischer Strom verwendet um chemische Reaktionen auszulösen. Zuerst benötigen wir eine Flüssigkeit, die Elektrizität leiten kann, wie zum Beispiel Wasser mit etwas Salz. Diese Flüssigkeit wird Elektrolyt genannt. Dann nehmen wir zwei Metallstäbe, die als Elektroden bezeichnet werden, und tauchen sie in die Elektrolytlösung. Eine Elektrode ist positiv geladen (Anode) und die andere negativ geladen (Anode). Anschließend schließen wir die Elektroden an eine Stromquelle an, wie zum Beispiel eine Batterie. Wenn der Strom fließt, ziehen die positiven Ionen im Elektrolyt zur negativen Elektrode (Kathode), während die negativen Ionen zur positiven Elektrode (Anode) gezogen werden. An den Elektroden finden chemische Reaktionen statt, bei denen die Ionen neue Verbindungen bilden oder in ihre elementaren Bestandteile zerlegt werden. Ein Beispiel für Elektrolyse ist die Zerlegung von Wasser in Wasserstoff und Sauerstoff. Dabei wird an der Anode Sauerstoff und an der Kathode Wasserstoff freigesetzt.
Das Redoxpotential und das Abscheidungspotential
Das Redoxpotential gibt an, wie leicht oder schwer eine Substanz Elektronen aufnehmen oder abgeben kann. Es ist ein Maß für die Tendenz einer chemischen Spezies, sich in einer Redoxreaktion zu verhalten. Redoxreaktionen sind chemische Reaktionen, bei denen eine Substanz Elektronen verliert (Oxidation) und eine andere Substanz Elektronen gewinnt (Reduktion). Ein hohes Redoxpotential bedeutet, dass die Substanz eher Elektronen aufnehmen (reduziert werden) möchte, während ein niedriges Redoxpotential darauf hindeutet, dass die Substanz eher Elektronen abgeben (oxidiert werden) möchte.
Das Abscheidungspotential ist die Spannung, die benötigt wird, um eine bestimmte Substanz an einer Elektrode abzuscheiden oder aufzulösen. Es ist die minimale elektrische Energie, die erforderlich ist, um eine Redoxreaktion an einer Elektrode zu ermöglichen. Beispielsweise wird in der Elektrolyse von Kupfersulfatlösung das Kupfer an der Kathode abgeschieden, wenn das angelegte Potential das Abscheidungspotential von Kupfer erreicht oder überschreitet. Das Abscheidungspotential kann von Faktoren wie der Konzentration der beteiligten Ionen und der Temperatur beeinflusst werden.
Das galvanische Element
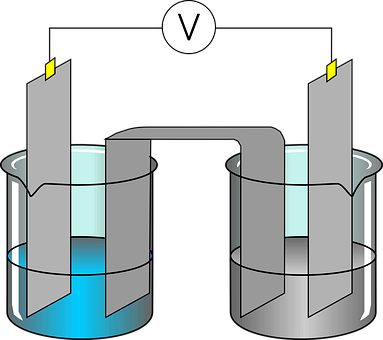
Ein galvanisches Element ist eine Vorrichtung zur spontanen Umwandlung von chemischer in elektrische Energie. Jede Kombination von zwei verschiedenen Elektroden und einem Elektrolyten bezeichnet man als galvanisches Element, und sie dienen als Gleichspannungsquellen. In einem galvanischen Element wird also elektrische Energie durch eine Redoxreaktion erzeugt. Es besteht im Wesentlichen aus zwei verschiedenen Metallelektroden, die in eine Elektrolytlösung getaucht sind. Jede Elektrode hat ein unterschiedliches Redoxpotenzial, das eine Spannung erzeugt, wenn die Elektroden über einen elektrischen Leiter verbunden werden. In einem galvanischen Element fließen Elektronen von der Elektrode mit dem höheren Redoxpotenzial zur Elektrode mit dem niedrigeren Redoxpotenzial . An der Anode findet eine Oxidation statt, bei der Elektronen freigesetzt werden, während an der Kathode eine Reduktion stattfindet, bei der Elektronen aufgenommen werden. Der Elektrolyt ermöglicht den Ionentransport zwischen den Elektroden, um den elektrischen Stromkreis zu schließen und die Reaktion aufrechtzuerhalten.
Die erste galvanische Zelle wurde 1800 von dem italienischen Wissenschaftler Alessandro Volta entwickelt und ist als Voltasche Säule bekannt. Galvanische Elemente sind die Grundlage für viele Arten von Batterien, die heute in einer Vielzahl von Anwendungen eingesetzt werden.
Die Elektrolyse und das galvanische Element sind wichtige Bausteine der Elektrochemie.