Molmassenbestimmung
Bestimmung der molaren Masse einer leichtflüchtigen Verbindung
Um in der empirischen Formel (CxHyOz)n
die Zahl n angeben zu können, muss die Molmasse der Verbindung bestimmt
werden.
Allgemeine Gasgleichung -
Zustandsgleichung idealer Gase
Ein „ideales“ Gas besteht in allen
Temperatur- und Druckbereichen aus Teilchen, die sich gegenseitig weder
abstoßen noch zusammenlagern.
Modellvorstellung: elastische,
kleinste Kugeln, die infolge ihrer thermischen Energie aufeinanderprallen.
Schließt man Gase in Gefäße mit einer beweglichen Wand ein, z.B. in einen
Zylinder mit Kolben, so hängt das Volumen einer Gasportion nur vom Druck p,
von der Temperatur T und der Teilchenmenge n ab.
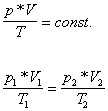
Erweiterung der allgemeinen
Gasgleichung:
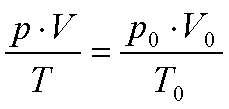
p0 = Normdruck: 1,013*105
N/m2
V0 = Volumen des Gases im
Normzustand
T0 = Normtemperatur:
273,15 K
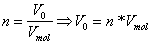
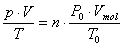
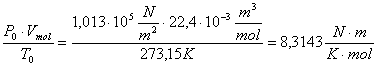
Gaskonstante R = 8,3143 NmK-1mol-1
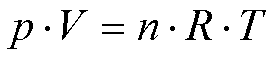
allgemeine Gasgleichung
Versuch (Übung):
Bestimmung der molaren
Masse von Magnesium:
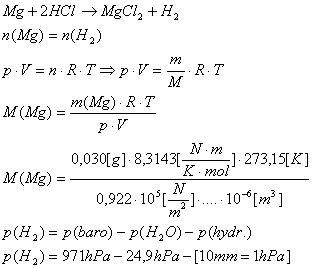
Bestimmung der molaren Masse
einer leichtflüchtigen Verbindung
nach dem Prinzip der
Luftverdrängung
Auswertung:
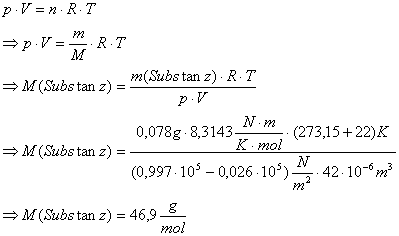
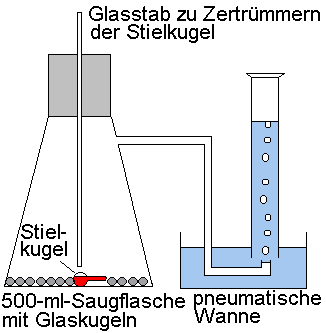
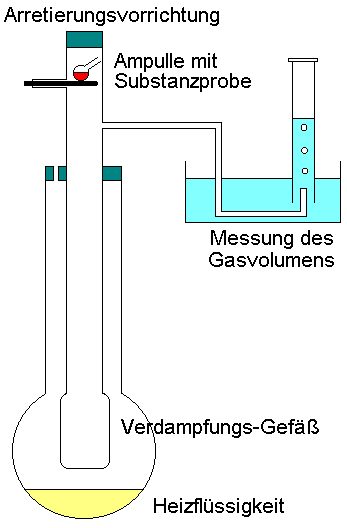
Dampfdichte-Bestimmung nach Victor Meyer
Dabei
wird das Volumen gemessen, das der Dampf einer genau gewogenen Probe der zu
untersuchenden Substanz einnimmt.
bei
der Auswertung zu berücksichtigen:
p(baro) = p(Luft) + p(H2O) +
p(hydro)
Sättigungsdampfdruck
hydrostatischer Druck
des Wassers der
Wassersäule
=> p(Luft) = p(baro) - p(H2O) - p(hydro)
Ermittlung der Summenformel aus
empirischer Formel und Molekülmasse (5h)
Bestimmung der Molekülmasse mit dem
Massenspektrometer
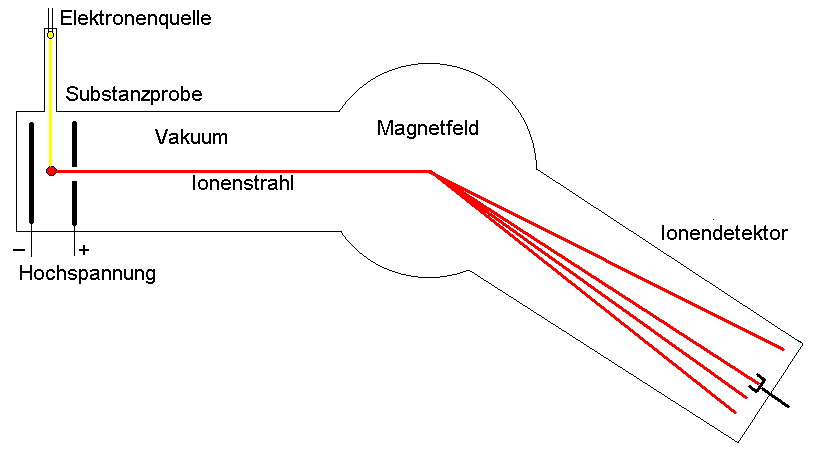
-
Ionisierung der Substanzprobe durch einen Strahl von schnellen Elektronen
liefert positiv geladenen Ionen durch Herausschlagen von Elektronen
-
Beschleunigung der Ionen durch ein elektrisches Feld (Abhängigkeit der
Geschwindigkeit von der Masse: leichtere Ionen bekommen höhere
Geschwindigkeit)
- Wenn
die Spannung variiert wird, verschiebt sich der Weg der Ionen. Beim
Auftreffen auf den Detektor wird ein Signal erzeugt.
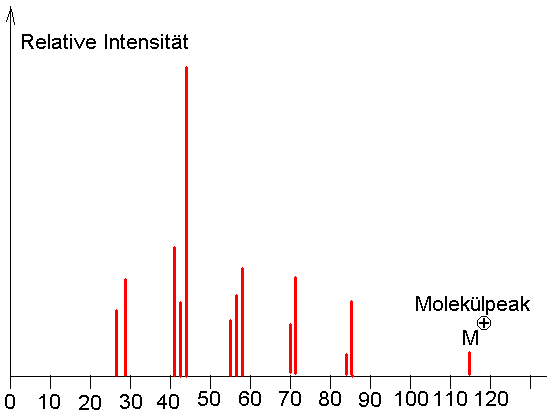
Massenspektrum von n-Octan C8H18
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3
Aufgaben zur
Molekülmassenbestimmung_und zur quantitativen Elementaranalyse:
[1987 II 1.1] Um die
Molekülmasse einer organischen Substanz zu bestimmen, wird ein Teil der zu
analysierenden Substanz in einem auf 393 K erhitzten 1-Liter-Gefäß
verdampft. Dabei erzeugen 1,000 g der Verbindung einen Druckanstieg von
0,545*105 N/m2. Berechnen Sie die Molekülmasse!
[Ergebnis: M = 60 u]
Lösung
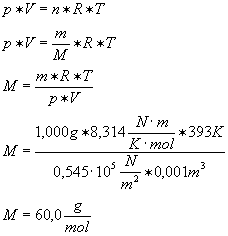
Ein Gefäß mit 20 mg
Methanol wird in einer 2,5 l fassenden, auf 80°C gewärmten Flasche
zertrümmert. Das Methanol verdampft und verdrängt 18,0 cm3 Luft
(Luftdruck: 0,998*105 N/m2).
Berechne die
Molekülmasse von Methanol!
[Ergebnis: M = 32,7
u]
Lösung
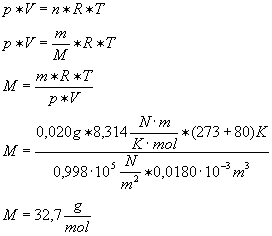
Mit Hilfe des
Verfahrens nach Viktor Meyer wird die Molekülmasse einer unbekannten
organischen Substanz X bestimmt. Bei einer Einwaage von 0,069 g bei 220°C
und 0,981*105 N/m2 entstehen 21 ml Gas.
Ermittle die
Summenformel der Verbindung X, wenn die Elementaranalyse 70,6% Kohlenstoff,
5,9% Wasserstoff und 23,5% Sauerstoff (Massenprozente) ergibt!
[Ergebnis: M = 137,3
u; Summenformel: C8H8O2]
Lösung
Berechnung der
Molmasse
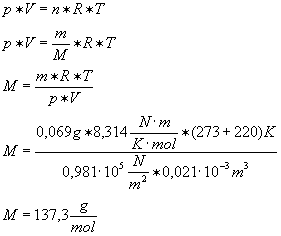
Berechnung der
Verhältnisformel
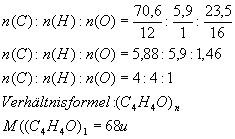
Summenformel: C8H8O2