|
Korrosion des Eisens (Rosten)
Chemische Reaktionen können schnell und langsam ablaufen, so ist das
Rosten eine sehr langsam verlaufende Reaktion (Oxidation) von Eisen mit
Sauerstoff und Wasser.
Durch die Einwirkung von Wasser und S auerstoff
auf Eisen bilden sich poröse Überzüge rotbrauner Farbe. Der Überzug
besteht aus der wechselnden Zusammensetzung von Eisenoxid / hydroxid.
Ist die Luft trocken so reagiert sie zusammen mit Sauerstoff nicht mit
dem Eisen. auerstoff
auf Eisen bilden sich poröse Überzüge rotbrauner Farbe. Der Überzug
besteht aus der wechselnden Zusammensetzung von Eisenoxid / hydroxid.
Ist die Luft trocken so reagiert sie zusammen mit Sauerstoff nicht mit
dem Eisen.
Wenn die Rostschichten dicker sind, blättern sie ab, sodass das darunter
liegende Eisen erneut von Wasser und Sauerstoff angegriffen (zerfressen)
wird.
Der Zustand des Rostens wird durch Salz (z.B. im Winter) beschleunigt.
Da Eisen eine unedles Metall ist, vollzieht sich dieser Vorgang leicht.
Diesen zerstörerischen Vorgang von Metallen durch äußere Umwelteinflüsse
nennt man Korrosion.
Man kann diesen Reaktionen aber auch durch verschiedene Schutzmaßnahmen
vorbeugen. Ein Beispiel dafür ist die Passivierung – das Überzeihen mit
unedleren Metallen, die eine stabile Oxidschicht bilden.
Überzieht man Metalle mit edleren Metallen so nennt man dies
Galvanisieren, Verzinken oder Verchromen. Um den Zutritt von Wasser zu
verhindern, kann man Metalle lackieren oder mit einem Kunststoffüberzug
versehen.
Um der Korrosion von Schiffen vorzubeugen, schütz man sie mit einer
Opferanode. Eine sogenannte Opferanode ist eine leitende Verbindung zu
einem Metall, das sich auflöst.
Heutzutage ist alles möglich! Rost ist nicht mehr nur noch ein
verhasster Schaden, er dient inzwischen sogar als Stilmittel für
Kunstobjekte. In Blumenläden bspw. findet man oftmals Vasen, die durch
eine Rostschicht auf der Oberfläche ein ganz besonderes Aussehen
bekommen. Ob es gefällt oder nicht, das ist Geschmackssache! Es beweist
allerdings, dass in unserer Gesellschaft selbst etwas scheinbar unnutzes
wie Rost einen mehr oder weniger sinnvollen Zweck zugedacht bekommt.
 Unter welchen Bedingungen rostet Eisen am stärksten und schnellsten?
Unter welchen Bedingungen rostet Eisen am stärksten und schnellsten?
Durchführung:
Wir testen die Reaktion von Eisen in verschiedenen Lösungen
(destilliertes Wasser, Sprudelwasser, Seifenlauge(Spüli) und
Kochsalzlösung) um zu sehen unter welchen Umständen Eisen am stärksten
und am schnellsten rostet.
Eisen
(Vorher metallisch glänzend, glatt)
 In destilliertem Wasser: leichte Rotfärbung des Metalls und an einigen
wenigen Stellen auch wenigst schwarz, einige rote Stückchen, die vom
Metall abgefallen sind, haben sich am Boden abgesetzt In destilliertem Wasser: leichte Rotfärbung des Metalls und an einigen
wenigen Stellen auch wenigst schwarz, einige rote Stückchen, die vom
Metall abgefallen sind, haben sich am Boden abgesetzt
In Sprudelwasser: stark rote und leicht schwarze Verfärbung, am Boden der
Lösung hat sich eine durchgehende und relativ hohe rote Schicht
abgesetzt, kein metallischer Glanz mehr an den verfärbten Stellen, rote
- bzw. schwarze Verfärbung nahe der Wasseroberfläche wesentlich stärker
In Seifenlauge: Das Eisen hat sich auch nach mehreren Tagen nicht
verändert
In Kochsalzlösung: spröde, eine bröckelige rote Schicht hat sich
gebildet, diese hat sich zum Teil vom Eisen abgelöst und schwimmt in der
Lösung und liegt am Boden, Großteil des Eisens nicht rot sondern
schwarz, unter der abgefallenen roten Schicht ist das Eisen heller und
dünner als vor dem Versuch, kein metallischer Glanz mehr an den
verfärbten Stellen, über der Wasseroberfläche hat sich eine weiße
Salzschicht am Eisen abgesetzt, stärkste Rotfärbung nahe
Wasseroberfläche, Schwarzfärbung weiter unten
 Fettung von Eisen
Fettung von Eisen
Früher hat man Eisenschrauben gefettet, um sie vor Korrosion zu
schützen.
Man kann sich gut vorstellen, wie sehr sich die Menschen früher
ärgerten, wenn sich das Gartentor mal wieder nicht schließen ließ, weil
das Eisenriegelschloss durchgerostet war. Kein Wunder, dass die Menschen
sich früher oder später Gedanken darüber machten, wie sie diesen
Situationen entgegenwirken konnten.
Was ließ sich tun? Schon bald wurde ihnen klar, dass die Korrosion (den
Begriff „Rosten“ benutzt man nur in Bezug auf Eisen) eine Reaktion von
Metallen und Sauerstoff ist, die bei feuchter Luft schneller
stattfindet. Ein Eisenriegel (z.B. vom Gartenzaun) ist ständig feuchter
Luft ausgesetzt und rostet daher schneller.
Irgendwie musste man die Reaktion von Sauerstoff, feuchter Luft und
Eisen unterbinden. Da die Menschen Möglichkeiten wie z.B. Verzinken
(siehe Seite 1, bzw. Aufgabe 6) nicht kannten, mussten sie zu andere n
Hilfsmitteln greifen. n
Hilfsmitteln greifen.
Jemand kam auf die Idee die zu schützenden Metalle einzufetten, da man
bereits aus Alltagssituationen das Einfetten kannte. Bsp: Auf
eingecremten Händen perlt Wasser ab. Denn fettete man ein Metall ein,
ist für den Sauerstoff keine metallenen Fläche vorhanden, mit welcher es
reagieren kann und keine Feuchtigkeit an das Metall dringen kann. Fett
schützt also vor Korrosion. Aber natürlich ist es kein dauerhafter
Schutz, da sich die Fettschicht abnutzt.
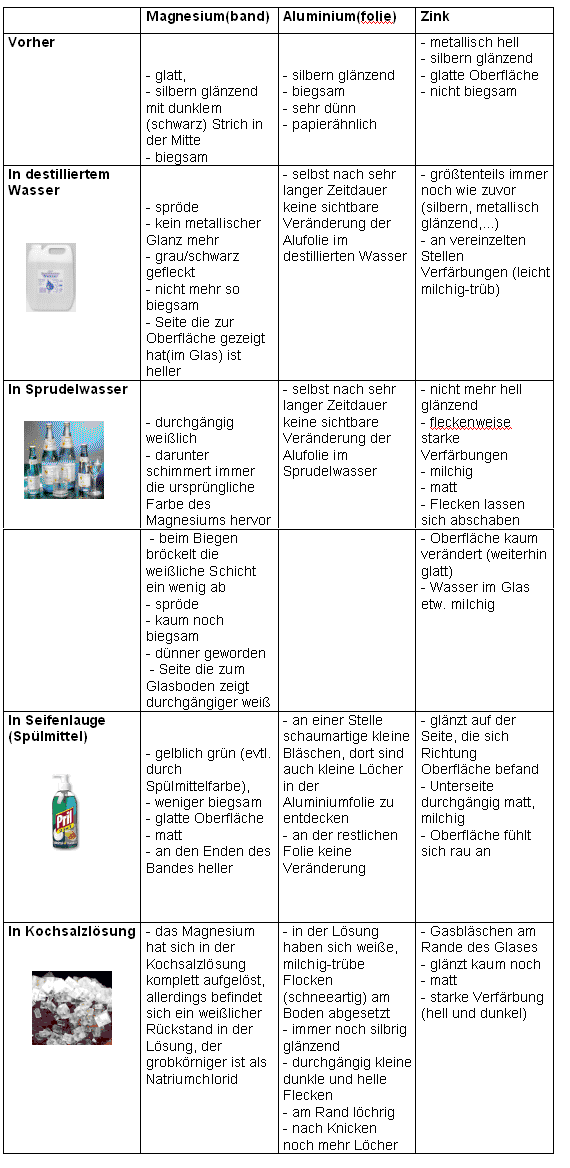
 Beobachtungen unserer Versuchsreihe
Beobachtungen unserer Versuchsreihe
Anmerkung: Messing fällt etwas aus dieser Versuchsreihe heraus, denn
Messing ist eine Legierung aus Kupfer und Zink. Alle anderen Metalle
sind Reinstoffe.
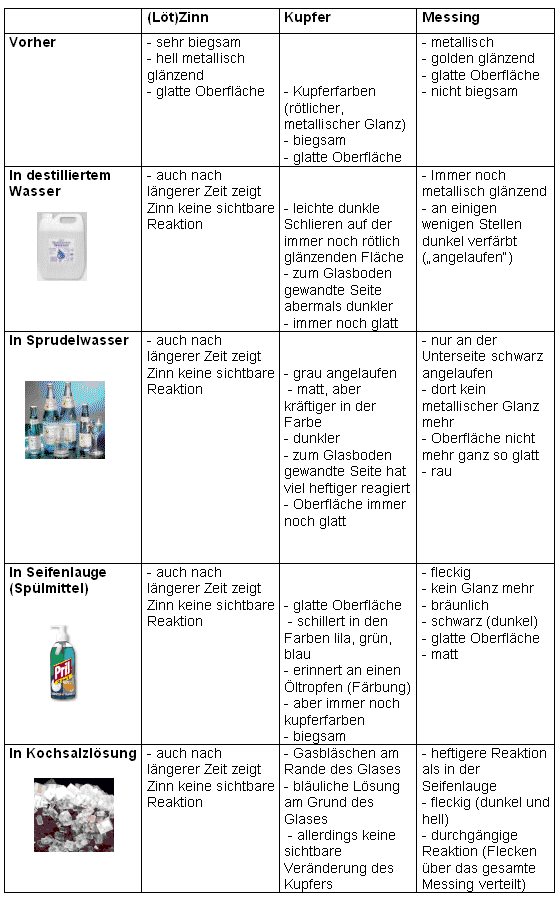
Die gleichen Versuche werden mit Zinn, Kupfer und Messing durchgeführt.
 Erklärung
Erklärung

Alle Metalle haben in den verschiedenen Lösungen korrodiert, also mit
Sauerstoff und Wasser reagiert.
Man kann allerdings je nach Lösung (Flüssigkeit) und Metall
unterschiedlich starke Veränderungen bei den Metallen feststellen.

E: 1.Destilliertes Wasser
Im destillierten Wasser sind keine Ionen vorhanden, welche die Korrosion
(s. Definition zu Beginn) in
 irgendeiner Form beschleunigen oder
verstärken können, deshalb korrodieren die Metalle in dieser „Lösung“ am
schwächsten von allen weiteren Lösungen unserer Versuchsreihe. irgendeiner Form beschleunigen oder
verstärken können, deshalb korrodieren die Metalle in dieser „Lösung“ am
schwächsten von allen weiteren Lösungen unserer Versuchsreihe.
Die Metalle reagieren wenig im destillierten Wasser, deshalb beobachtet
man die Veränderungen nur fleckenweise auf den Metalloberflächen.
Ist ein Metall nur destilliertem Wasser ausgesetzt dauert das
Korrodieren einige Wochen.
E: 2.Sprudelwasser
Im Sprudelwasser korrodieren die Metalle schon stärker, weil das
Sprudelwasser mit anderen Stoffen versetzt ist. Das von uns benutzte
Wasser enthielt z.B. Ca2+ Ionen, Mg2+Ionen und wie jedes Sprudelwasser
Kohlensäure. Wir glauben, dass diese Ionen die Korrosion beschleunigt
und unterstützt haben, deswegen konnte man eine heftige re Reaktion
beobachten (z.B. stärkere Verfärbungen). re Reaktion
beobachten (z.B. stärkere Verfärbungen).
Zusatzstoffe im Wasser wie z.B. Kohlenstoffdioxid fördern also die
Korrosion von Metallen. Man kann davon ausgehen, je konzentrierter diese
Zusatzstoffe vorhanden sind, desto stärker korrodieren die Metalle.
Wir haben das Mineralwasser mit Rotkohlsaft (Indikator)getestet und da
sich die Lösung pink gefärbt hat, können wie davon ausgehen, dass das
Mineralwasser sauer ist. (Hier sind H3O+ Ionen in Mineralwasser
enthalten, vergleiche Aufgabe 5)
Beispiel aus dem Alltag:
Im Regenwasser befindet sich ebenfalls eine große Menge
Kohlenstoffdioxid, weshalb wir vermuten, dass Regenwasser die Korrosion
mindesten genauso stark wie Sprudel fördert. Je größer die
Umweltverschmutzung ist, desto stärker ist die Luft mit Schadstoffen
versehen, die ebenfalls die Korrosion fördern.
E: 3.Seifenlauge (Spülmittel)
Wir sind uns nicht völlig sicher, ob die Metalle stärker im
Sprudelwasser oder in der Seifenlauge reagiert haben, da unsere
Beobachtungen nicht ganz eindeutig sind.
Es spricht aber einiges dafür, dass die Metalle in der Seifenlauge
stärker reagieren.
Bsp.:
 Aluminium hat in der Seifenlauge, aber nicht im Sprudel reagiert.
Andererseits hat Eisen im Sprudel, aber nicht in der Seifenlauge
reagiert. Wir wissen, dass dies mit einer Resistenz Eisens gegen kalte
Laugen zu tun hat. Aluminium hat in der Seifenlauge, aber nicht im Sprudel reagiert.
Andererseits hat Eisen im Sprudel, aber nicht in der Seifenlauge
reagiert. Wir wissen, dass dies mit einer Resistenz Eisens gegen kalte
Laugen zu tun hat.
Wir gehen deshalb davon aus, dass bei Metallen in der Seifenlauge eine
relativ heftige Korrosion stattgefunden hat, da sich die Farbe der
Metalle verändert hat und sie matt geworden sind (Ein neuer Stoff,
Metallhydroxid, ist also entstanden).
Man kann daraus schließen, dass alkalische Lösungen die Korrosion von
Metallen fördern.
E: 4.Kochsalzlösung
Unserer Beobachtung zu Folge unterstützt Natriumchlorid die Korrosion
von Metallen am stärksten. Die M etalle in unserer Versuchsreihe haben
sehr stark reagiert, bspw. Magnesium hat sich vollständig aufgelöst,
außerdem konnten wir in den Salzlösungen am frühsten Anzeichen von
Korrosion feststellen. etalle in unserer Versuchsreihe haben
sehr stark reagiert, bspw. Magnesium hat sich vollständig aufgelöst,
außerdem konnten wir in den Salzlösungen am frühsten Anzeichen von
Korrosion feststellen.
Vermutlich beschleunigen und verstärken Salzlösungen (gelöste
Verbindungen aus Metallen und Nichtmetallen) also das Korrodieren von
Metallen. Metalle geben bei der Korrosion Elektronen ab, Ionen in der
Salzlösung sorgen dabei für einen geschlossenen Stromkreis.
Beispiel aus dem Alltag:
Wird im Winter bei Schnee und Eis Salz gestreut, bildet sich solch eine
Lösung, wie wir sie in unseren Versuchen verwendet haben (Zusätzlich
sind hier noch die Schadstoffe aus der Luft enthalten). Befindet sich
unter der Salz-Schneemischung also ein metallener Gegenstand findet eine
starke Korrosion statt. Folglich besteht im Winter, sofern man mit Salz
streut, eine stärkere Korrosionsgefahr.
Hier spielt wieder die Bildung von Lokalelementen eine Rolle. Ein Teil
des Metalls ist Anode, ein anderer Kathode ( hier kann O2 reduziert
werden.)
Salzwasser fördert diesen Vorgang, da die in Wasser gelösten Ionen dafür
sorgen, dass der Stromkreis geschlossen wird.
 Spezielle Erklärungen:
Spezielle Erklärungen:
 Eisen Eisen
Eisen hat beim Korrodieren eine große Besonderheit, das Oxid des Eisens
ist so porös, dass es abfällt und neues Eisen freilegt, welches wieder
rostet. Dies ist auch der Grund dafür, warum sich beim Eisen stets eine
rote Schicht am Grund der Lösung befindet. Wir vermuten, dass das Eisen
zum Teil schwarz ist, da es beim Korrodieren erst Eisenionen bildet und
diese dann mit den Hydroxidionen, welche sich aus Wasser und Sauerstoff
gebildet haben, zu rotem Rost reagieren.
Aluminium
Wir sind uns nicht sicher, warum Aluminium im Gegensatz zu den anderen
Metallen weder mit destilliertem noch mit Sprudelwasser reagiert, da es
unedeler als bspw. Kupfer ist. Vielleicht ist dies einfach eine Eigenart
des Metalls oder es liegt daran, dass Alufolie nicht nur aus Aluminium
besteht.
Aluminium korrodiert heftiger als Eisen (es ist unedler), aber die
entstehende Oxidschicht aus Aluminiumoxid bildet einen geschlossenen
Überzug über das Metall dadurch wird eine weitere Oxidation verhindert.
Lötzinn
Wir vermuten, dass unsere Versuche mit dem Lötzinn fehlgeschlagen sind,
da Lötzinn sehr dünn ist, es bietet sich nicht genug Fläche zum
Reagieren, und dass der Lötzinn aus dem Baumarkt möglicherweise
eingefettet war, da die Käufer schließlich nichts mit korrodierendem
Lötzinn anfangen können.
Kupfer
Wir haben uns gewundert, warum wir bei Kupfer in Salzlösung keine Veränderung beobachten konnten, da die übrigen Metalle in der Salzlösung
stets am stärksten reagiert hatten. Unserer Meinung nach liegt die
Lösung für dieses Problem in der aufgetretenen bläulichen Verfärbung der
Lösung. Denn dies beweist, dass das Kupfer auf jeden Fall irgendwie
reagiert (korrodiert) hat, da eine bläuliche Färbung einer Lösung ein
Nachweis für Cu2+ Ionen ist. Das Kupfer geht bei der Korrosion also in
Lösung. So konnte man nur die Verfärbung des Wassers beobachten.
Zusammenfassung der Ergebnisse
Anhand unserer Beobachtungen haben wir festgestellt, dass man bei
gleicher Lösung bei den Metallen einen durchgängigen Unterschied in der
Heftigkeit der Reaktion (Korrosion) feststellen kann.
(Messing kann nicht in diese Reihe aufgenommen werden, da es eine
Legierung ist.)
Bei dieser Versuchsreihe haben wir festgestellt, dass unsere
Beobachtungen die uns bereits aus dem Chemieunterricht bekannte Redoxreihe (festgelegte Reihenfolge der Metalle von unedel nach edel; s.
Abbildung Aufgabe 6) bestätigt.
Je unedler das von uns gewählte Metall war, desto stärker reagierte es
in den jeweiligen Lösungen.
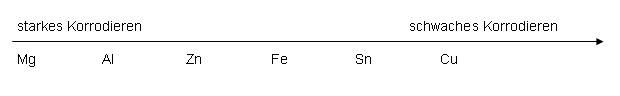
Bsp.:
Magnesium löst sich in der Kochsalzlösung auf, während Messing nur
leichte Veränderungen aufweist.
Also sind unedle Metalle verständlicherweise für den Normalgebrauch
ungeeigneter als edle Metalle, da sie schneller korrodieren.

Beispiel aus dem Alltag:
Bei der Schmuckherstellung werden Gold und Silber nicht nur wegen ihres
Glanzes benutzt, sondern auch weil sie so edel sind, dass sie unter
normalen Umständen kaum korrodieren (siehe auch Versilberung von
„unedlen“ Schmuckstücken).
 Aluminiumfolie und feuchte, salz- und säurehaltige Lebensmittel
Aluminiumfolie und feuchte, salz- und säurehaltige Lebensmittel
Aufbau: Sauerkraut, Aluminiumfolie, eine Schüssel
Durchführung:
Wir füllen unser Sauerkraut in eine Schüssel und decken die Glasschüssel
luftdicht mit Alufolie ab. Wir stellen die Schüssel für eine Woche in
den Kühlschrank.
Beobachtung:
Nachdem wir das Sauerkraut aus dem Kühlschrank genommen haben, sehen wir
keinerlei Veränderung. Wir nehmen die Aluminiumfolie von der
Glasschüssel aber auch von unten weist die Aluminiumfolie keine
sichtbaren Veränderungen auf und auch das Sauerkraut hat sich bis auf
einen wesentlich durchdringenderen Geruch im Vergleich zur Vorwoche
nicht verändert.
Warum hat unser Versuch nicht funktioniert?
Wir fragen uns natürlich warum unser Experiment nicht funktioniert hat
und was eigentlich hätte passieren müssen. Auf der Packung unserer
Aluminiumfolie finden wir in beiden Hinsichten einen Hinweis.
„Aluminiumfolie nicht zum Abdecken von feuchten, säure- oder
salzhaltigen Lebensmitteln auf Servierplatten oder Schalen aus Metall
verwenden. Folien können sich infolge Lokalelementbildung auflösen.
Aluminiumfolien nicht in Verbindung mit in Salzwasser gekochten, stark
säure- oder salzhaltigen Lebensmitteln benutzen. An Lebensmittel
abgegebene Aluminiumbestandteile sind jedoch nicht
gesundheitsschädlich.“ (aus: Toppits, Kraftwaben Aluminiumfolie)
Für uns interessant ist der Hinweis auf die Schalen von Metall.
Vielleicht liegt das Sch eitern unseres Versuches daran, dass wir eine
Schale aus Glas benutzt haben, die nicht leitet ,durch welche keine
Ionen wandern können? eitern unseres Versuches daran, dass wir eine
Schale aus Glas benutzt haben, die nicht leitet ,durch welche keine
Ionen wandern können?
Vielleicht war unser Weinsauerkraut aber auch einfach nicht sauer genug.
Die plausibelste Erklärung ist unserer Meinung nach schlußendlich aber,
dass das Sauerkraut die Alufolie nicht direkt berührt hat. Sonst hätte
sich mit Sicherheit ein oben genanntes Lokalelement gebildet. Die uns
fehlende Beobachtung hat uns auf jeden Fall die Verpackung geliefert.
Wir fragen uns aber trotzdem, was genau ist so ein Lokalelement
eigentlich?
Was ist ein Lokalelement und was hat es mit unserem Versuch zu tun?
Wir suchen im Internet nach „Lokalelement“ finden aber keine genaue
Definition, sondern lediglich Hinweise zu galvanischen Zellen.
(Google, Suchbegriff: „Lokalelement“) Ein Lokalelement scheint also eine
Art galvanische Zelle zu sein, welche die Korrosion beschleunigt.
Allerdings haben wir mit der Aluminiumfolie nur ein Metall vorliegen -
zu einer galvanischen Zelle benötigen wir aber eigentlich zwei.
Erklärung: Warum löst sich die Aluminiumfolie auf?
Wir vermuten, dass sich die Aluminiumfolie infolge von Korrosion
auflöst. Wie wir in unseren vorangegangenen Versuchen festgestellt
haben, fördern Salz (salzhaltige Lebensmittel), Säure (säurehaltige
Lebensmittel) und Wasser (feuchte Lebensmittel)
die Korrosion. Verschließt man solche Lebensmittel nun also mit sehr „unedler“(Redoxreihe)
Aluminiumfolie beginnt diese unter dem Einfluss der Lebensmittel und des
Sauerstoffs zu korrodieren. Anscheinend ist diese Korrosion so stark,
dass sich sogar Teile der Aluminiumfolie auflösen und durch die
Metallschüssel in die Lebensmittel wandern. Laut Hersteller sind
Al-hydroxidionen (diese bilden sich beim Korrodieren) zwar nicht giftig,
man sollte oben genannte Lebensmittel aber trotzdem nicht mit
Aluminiumfolie abdecken.
Lokalelemente spielen ebenfalls eine wichtige Rolle. Wie bereits oben
beschrieben beschleunigen sie die Korrosion. Da wir aber nur ein Metall
vorliegen haben, vermuten wir, dass die Alufolie sowohl die Funktion der
Anode als auch der Kathode übernimmt.
D.h., dass ein Teil des Aluminiums oxidiert wird, er gibt also
Elektronen ab (hier befindet sich offensichtlich die Anode) und ein
anderer Teil des Aluminiums dient als Kathode. Die Elektronen, die vom
Aluminium abgegeben wurden, wandern zu einem anderen Teil der
Aluminiumfolie, diese fungiert als Kathode. In Säuren, so auch in
Sauerkraut, sind immer H3O+Ionen enthalten. Diese nehmen an der Kathode
Elektronen auf und entladen sich somit.
Anodenvorgang (Oxidation): 2Al -> 2Al3+ + 6e-
Kathodenvorgang (Reduktion): 6H3O+ + 6e- -> 3H2+ 6H2O
Es hat sich also Wasser und Wasserstoff gebildet. Diesen Vorgang kann
man auch mit einer galvanischen Zelle vergleichen, obwohl nur ein Metall
vorhanden ist.
Nimmt man an, das Sauerkraut wäre auf einer Silberplatte angerichtet und
mit Alu folie abgedeckt, so laufen eben jene Vorgänge ab, die wir
vorangehend beschrieben haben, nur dass die Alufolie diesmal nur die
Anode bildet und die Silberplatte die Kathode bildet. (galvanisches
Element) Das heißt, die H3O+ Ionen entladen sich diesmal an der
Silberplatte. Die Reaktionsgleichungen bleiben aber die gleichen. folie abgedeckt, so laufen eben jene Vorgänge ab, die wir
vorangehend beschrieben haben, nur dass die Alufolie diesmal nur die
Anode bildet und die Silberplatte die Kathode bildet. (galvanisches
Element) Das heißt, die H3O+ Ionen entladen sich diesmal an der
Silberplatte. Die Reaktionsgleichungen bleiben aber die gleichen.
Vergleich:
Steckt man zwei verschiedene Metalle in eine Zitrone oder einen Apfel
(säurehaltig) so bildet sich ebenfalls ein galvanisches Element, das dem
obigen bis auf die Bestandteile (Sauerkraut/Apfel, Zitrone) völlig
gleicht.
Heutzutage ist man weitgehend davon abgekommen Eisen zu fetten (s. Aufg.
3), da es zuverlässigere Schutzmittel gibt. Man verzinkt Eisen:
 Verzinken von Eisen
Verzinken von Eisen
Wäre Eisen ungeschützt, dann würde es so lange rosten (Oxidieren), bis
nur noch poröses Eisenoxid vorhanden wäre, und der Gegenstand zerfiele.
Man verzinkt Eisen, da es Metalle gibt, die in der Verbindung mit
Sauerstoff nicht bröckelig und porös sind. Während Eisenoxid von dem
noch darunterliegenden Eisen abblättert und dieses somit weiter rostet
(bis irgendwann nichts mehr davon vorhanden ist), bildet bspw. Zink bei
der Reaktion mit Sauerstoff eine Schicht (Zinkoxid), die das
darunterliegende Metall überzieht und aufgrund ihrer Dichte vor weiteren
chemischen Reaktionen („Angriffen“) schützt. Verzinkt man also Eisen und
es korrodiert, bildet die Zinkschicht Zinkoxid welches nun das Eisen vor
dem Rosten schützt. Bei der Verwendung des Metalls hat man aber
praktischerweise immer noch Eisen vorliegen.
Allerdings gibt es noch einen zweiten Grund, welcher dafür spricht, dass
man Eisen verzinken sollte. Dies ist die Redoxreihe:

Zink ist (s. Abbildung) unedler als Eisen, d.h. es ist
reaktionsfreudiger. Ist eine Beschädigung in der Zinkschicht rostet das
Eisen trotzdem nicht, weil der dazukommende Stoff lieber mit dem
unedleren Zink reagiert.
Somit gewährleistet Zink für
Eisen einen Rundumschutz.
Man nennt Verzinken auch Passivierung.
(s. Einleitung)
Wenn Zink korrodiert, gibt es Elektronen ab. In Wasser gelöster
Sauerstoff nimmt diese Elektronen auf und Bildet Hydroxidionen. Die
Zinkionen reagieren dann mit den Hydroxidionen und Sauerstoff.
Reaktionsgleichungen:
Oxidation: 2Zn(s) -> 2Zn2+(aq) + 4e-
Reduktion: O2(aq) + 2H2O (l) + 4e- -> 4 OH- (aq)
 Vorgehensweise
Vorgehensweise
 Anfangs überlegten wir uns mit welchen beiden Metallen wir eine
möglichst große Spannung erzielen könnten, so kam uns die Idee ein
unedles und edles Metall zu wählen, da unedle Metalle ihre Elektronen
besonders gerne an edle Metalle abgeben (siehe Redox/Spannungsreihe
Aufgabe 6). Unsere Chemielehrerin sagte uns, dass sie uns die benötigten
Chemikalien aus der Schulchemiesammlung zur Verfügung stellen könnte.
Jedoch mussten wir einsehen, dass Kalium so reaktionsfreudig ist, dass
es sogar in Petroleum aufbewahrt werden muss und Gold in der
Schulsammlung nicht vorhanden ist. Anfangs überlegten wir uns mit welchen beiden Metallen wir eine
möglichst große Spannung erzielen könnten, so kam uns die Idee ein
unedles und edles Metall zu wählen, da unedle Metalle ihre Elektronen
besonders gerne an edle Metalle abgeben (siehe Redox/Spannungsreihe
Aufgabe 6). Unsere Chemielehrerin sagte uns, dass sie uns die benötigten
Chemikalien aus der Schulchemiesammlung zur Verfügung stellen könnte.
Jedoch mussten wir einsehen, dass Kalium so reaktionsfreudig ist, dass
es sogar in Petroleum aufbewahrt werden muss und Gold in der
Schulsammlung nicht vorhanden ist.
So entschieden wir uns für Magnesium und Kupfer. Aus der Schulsammlung
gab man uns etwas Magnesium- und Kupfersulfat, das wir in Wasser lösten
(siehe Foto).
 Um einen Stromkreis zu bauen, gossen wir die Kupfersulfatlösung in einen
kleinen Blumentopf aus Ton und stellten diesen in einen Behälter mit der
Magnesiumsulfatlösung.( Wir wählten einen Tontopf, da wir einen
Behälter, der ionendurchlässig ist, benötigten, um einen geschlossenen
Stromkreis zu garantieren.) Als nächstes befestigten wir die beiden
Metalle (ein Kupferblech und ein Magnesiumband) an je einer
Krokodilsklemme. Die Kabel verbanden wir mit einem Voltmeter. Das
Magnesiumband hielten wir in die Magnesiumsulfatlösung und das Kupfer in
die Kupfersulfatlösung. Wir stellten das Voltmeter auf DC
(Gleichspannung) und maßen eine Spannung von 1.6 Volt. Um einen Stromkreis zu bauen, gossen wir die Kupfersulfatlösung in einen
kleinen Blumentopf aus Ton und stellten diesen in einen Behälter mit der
Magnesiumsulfatlösung.( Wir wählten einen Tontopf, da wir einen
Behälter, der ionendurchlässig ist, benötigten, um einen geschlossenen
Stromkreis zu garantieren.) Als nächstes befestigten wir die beiden
Metalle (ein Kupferblech und ein Magnesiumband) an je einer
Krokodilsklemme. Die Kabel verbanden wir mit einem Voltmeter. Das
Magnesiumband hielten wir in die Magnesiumsulfatlösung und das Kupfer in
die Kupfersulfatlösung. Wir stellten das Voltmeter auf DC
(Gleichspannung) und maßen eine Spannung von 1.6 Volt.
Elektrodenvorgänge unserer g alvanischen Zelle alvanischen Zelle
Die Magnesiumatome der Magnesiumelektrode geben 2 e¯ in das Kabel ab,(es
entstehen Mg 2+ Ionen) da sich diese mit den Ionen der
Kupfersulfatlösung verbinden wollen (Kupfer ist edler als Magnesium).
Während die Elektronen durch das Kabel wandern, gehen die Magnesiumionen
in die Magnesiumsulfatlösung.
Dieser Vorgang wird wiederholt bis keine Mg-Atome mehr vorhanden sind.
Die Elektronen wandern durch das Kabel zum Kupferblech, doch
da die Kupferatome keine weiteren Elektronen aufnehmen können, nehmen
die Cu2+ Ionen die e- auf. Es bilden sich Kupferatome und so entsteht an
der Oberfläche des Kupferbleches weiteres Kupfer.
Dieser Vorgang ist erst beendet, wenn keine weiteren Kupferionen in der
Lösung vorhanden sind oder das Magnesium keine Elektronen mehr hat.
Durch die Bildung der Kupferatome herrscht in der Kupfersulfatlösung
bald ein Sulfat-Ionenüberschuss, während in der Magnesiumsulfatlösung
durch die in Lösung gegangenen Mg2+Ionen ein Sulfat-Ionenmangel besteht.
Die überzähligen Sulfat-Ionen in der Kupfersulfatlösung gelangen durch
den Blumentopf (ionendurchlässig s.o.) in die Magnesiumsulfatlösung und
gleichen den dort herrschenden Mangel aus. Das Gleichgewicht in den
Lösungen ist wieder hergestellt und gleichzeitig besteht ein
geschlossener Stromkreis, der zum Stromerzeugen von Nöten ist .
Unsere Freude war riesig, das alles geklappt hatte.
Wir entsorgten das gelöste Kupfersulfat in den Schwermetallsalzabfällen
unserer Schule, da Kupfer ein Schwermetall ist. |