Chromatographische
TrennverfahrenGrundlagen
der Chromatographie
Versuche: Demonstration von
Adsorption und Verteilung; ggf. Computersimulation zur Veranschaulichung
Chromatographie ist eine
physikalisch-chemische Trennmethode zur Trennung flüssiger und gasförmiger
Stoffgemische.
Dabei wird das
Gemisch mit Hilfe einer Flüssigkeit oder eines Gases - der beweglichen oder
mobilen Phase - an einem festen oder flüssigen Stoff von großer
Oberfläche - der stationären Phase - vorbeigeführt. Die einzelnen
Substanzen werden von der stationären Phase in unterschiedlichem Ausmaß
zurückgehalten aufgrund der Prinzipien Adsorption und Verteilung
1. Adsorption
Versuche:
- Adsorption von Methylenblau an Kieselgel
(Kieselgel mit Methylenblaulösung schütteln,
absetzen lassen)
Ergebnis: Kieselgel fängt anscheinend den
Farbstoff aus der Lösung heraus.
- Adsorption von Brom durch Aktivkohle
(In einen Rundkolben mit Bromdämpfen wird
Holzkohlepulver gegeben und geschüttelt)
Ergebnis: Entfärbung - Der Bromdampf wurde
an die Kohle adsorbiert - vergl. Gasmaskenfilter.
Bei der
Adsorption werden Gase oder gelöste
Stoffe auf der Oberfläche eines Feststoffes reversibel angelagert (Van-der-Waals-Kräfte,
Dipol-Dipol-Wechselwirkungen, Wasserstoffbrückenbindungen).
Je größer die Oberfläche des
Adsorptionsmittels, desto größer die adsorbierbare Stoffmenge.
Die Adsorption ist spezifisch, d.h. ein
Adsorptionsmittel bindet verschiedene Stoffe unterschiedlich stark
Versuch: Aus Rundfilter drei Tropfen
Farbstofflösung von Methylenblau, Eosin und Methylorange eintrocknen lassen,
dann auf die Mitte jedes Farbflecks etwas Wasser geben.
Ergebnis?
Auf der unterschiedlichen Adsorption
verschiedener Stoffe kann man somit ein Trennverfahren aufbauen.
Vergleich: Fluß - Ufer - Schwimmer
(Tafelskizze, farbig)
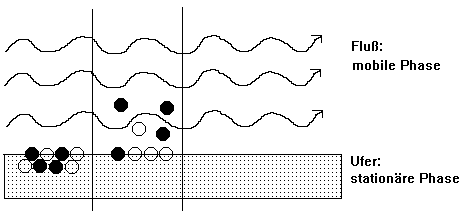
2. Verteilung:
Bei der
Verteilung zwischen zwei Phasen
spielt die unterschiedliche Löslichkeit eines Stoffes in zwei miteinander
nicht oder nur beschränkt mischbaren Lösungsmitteln eine Rolle.
Das Verteilungsverhältnis ist (bei einer bestimmten
Temperatur) konstant (Nernstscher Verteilungskoeffizient) und
stoffspezifisch.
Versuch: Verteilung von Iod
zwischen Wasser und Benzin
Ergebnis: der gelöste Stoff verteilt
sich auf die beiden Lösungsmittel.
Anwendung bei der Chromatographie
Durch die Summierung vieler
Einzelschritte können noch Substanzen getrennt werden, die sich in ihren
Lösungseigenschaften nur geringfügig unterscheiden.
Durch Wahl geeigneter stationärer
und mobiler Phasen kann die Trennung optimiert werden.
[3. Ionenaustausch]
Ähnlichkeit mit
Adsorptionschromatographie: die stationäre Phase besitzt ionisierbare
Gruppen, z.B. -COOH, -SO3H oder -NH2. An das Festion
ist ein Gegenion reversibel gebunden. Dieses Gegenion kann gegen
gleichgeladene Ionen der vorbeiziehenden Lösung ausgetauscht werden.
z.B. Kationenaustauscher
[4. Molekülsiebung]
Trennung nach Molekülgröße: Kleinere
Moleküle können in die Poren eines Molekülsiebs (z.B. Gel) eindringen und
wandern daher langsamer als die größeren.
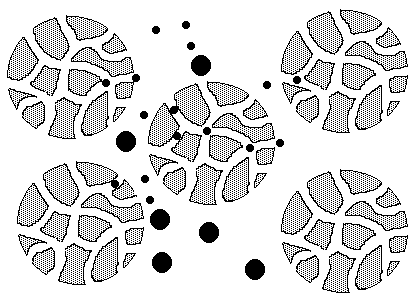
Spezielle Techniken der Chromatographie
| Stationäre
Phase |
Mobile Phase |
Verfahren |
| fest oder flüssig |
gasförmig |
Gaschromatographie
(nur für verdampfbare Substanzen:20%) |
| fest |
flüssig |
Adsorptionschromatographie
Ionenaustauschchromatographie |
| flüssig |
flüssig |
Verteilungschromatograpie
Gelchromatographie |
Papierchromatographie PC
(Streifen- Zylinder- Rundfiltermethode; aufsteigend, absteigend, ein- oder
zweidimensional)
Dünnschichtchromatographie DC
(meist Kieselgel oder Cellulose auf Alu oder Plastikfolie)
Säulenchromatographie (heute
meist HPLC)
Durch Variation des Trägermaterials
und der mobilen Phase gibt es kaum ein Stoffgemisch, das nicht
chromatographisch getrennt werden kann.
Auswertung von Chromatogrammen
Rf-Wert zur
Kennzeichnung der Wanderungsgeschwindigkeit:
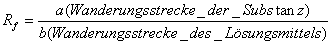
Maximalwert: 1
Abhängigkeit vom Laufmittel
Dünnschicht-
und Papierchromatographie - Praktikum
1. Vorbereitung des C-Papiers bzw.
der DC-Platte nach folgendem Schema (mit Bleistift!):
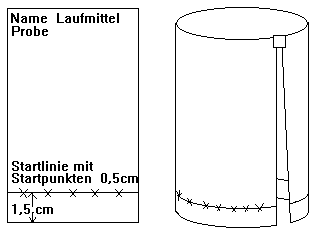
2. Auftragen der Substanzen: Mit
einer Kapillarpipette werden auf der Startlinie (1,5 cm vom unteren Rand, 1
cm vom seitlichen Rand entfernt) in Abständen von 1 cm (Papier) bzw. 0,5 cm
(DC-Platte), die Proben augetragen. Die Flecken sollen möglichst klein
gehalten werden. Das erreicht man durch portionsweises Auftragen, wobei man
zwischendurch die Flecke im Luftstrom trocknet.
3. Entwickeln: Das Papier wird zu
einem Zylinder gerollt und in dieser Lage festgeklammert, ohne daß sich die
Ränder berühren.
Das so vorbereitete Chromatogramm
stellt man, ebenso wie die DC-Platten in eine vorbereitete Kammer (0,5 cm
hoch mit Laufmittel gefüllt, Kammeratmosphäre gesättigt mit
Laufmitteldämpfen). Das fertige Chromatogramm wird herausgenommen und nach
Markieren der Frontlinie getrocknet.
4. Bestimmung der Rf-Werte der
Substanzflecke und Identifizierung der Substanzen durch Co-Chromatographie,
Vergleich mit Literaturergebnissen.
Aufgaben:
Bei der Chromatographie eines
Blattextrakts auf Kieselgel als stationärer Phase und mit einem
Benzin-Aceton-Gemisch als mobiler Phase (Laufmittel) wurde das abgebildete
Chromatogramm erhalten. Verwenden Sie zur Beantwortung der Fragen die
angegebenen Strukturformeln.
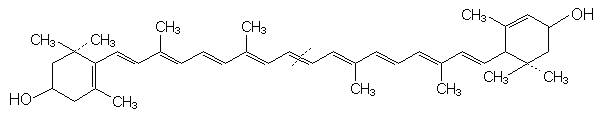
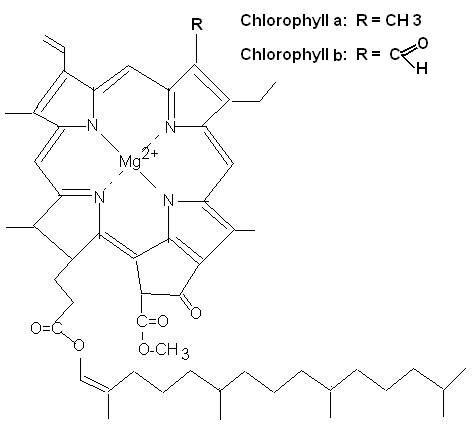
Ordnen Sie die
zwei grünen Banden den beiden Chlorophyllen a und b zu und die beiden gelben
Banden den Carotinoiden b-Carotin
und Lutein (mit Begründung).
Berechnen Sie
die Rf-Werte der vier Farbstoffe
Welches
Strukturmerkmal ist für die Farbigkeit der vier Verbindungen verantwortlich?

Carotin
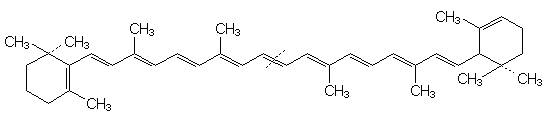
Lutein
Chlorophyll a
und b
Kieselgel
Abituraufgabe 1998_III_3
Aufgabe 3 mit
Lösung (Prinzip, Saccharide - Detektion durch Reduktionsvermögen -
Rf-Werte-Berechnung - Co-Chromatographie
3 Die Trennung und Identifizierung von
Sacchariden gelingt mit Hilfe chromatografischer Verfahren.
3.1 Erklären Sie das Prinzip der Chromatografie
am Beispiel der Dünnschicht- oder Papierchromatografie! [4 BE]
3.2 Voruntersuchungen eines Saccharid-Gemisches
deuten daraufhin, dass es Glucose, Maltose und/oder Saccharose enthalten
könnte. Das Gemisch wird chromatografisch getrennt. Das entwickelte
Chromatogramm wird mit ammoniakalischer Silbernitrat-Lösung besprüht und
erwärmt. Geben Sie an, welches der oben genannten Saccharide mit dieser
Methode sichtbar gemacht werden kann, und begründen Sie Ihre Aussage!
Stellen Sie für eine Reaktion die Gleichung auf. [5 BE]
3.3 Ein Kohlenhydrat-Gemisch unbekannter
Zusammensetzung wird chromatografisch getrennt und die einzelnen
Bestandteile werden mit Hilfe verschiedener Sprühreagenzien sichtbar
gemacht. Die Abbildung zeigt das fertige Chromatogramm:
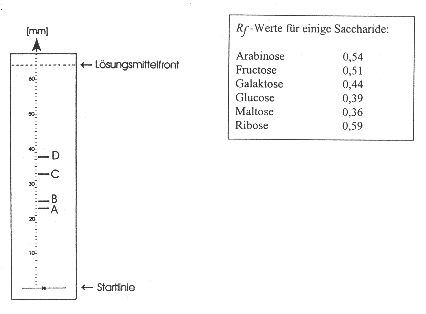
Ermitteln Sie mit Hilfe der gegebenen Rf-Werte,
ob in dem Gemisch Fructose enthalten war, und begründen Sie Ihre Aussage! [3
BE]
3.4 Die Identifizierung von Kohlenhydraten kann
auch mit Hilfe eines Co-Chromatogramms erfolgen. Beschreiben Sie die
Durchführung dieses Verfahrens und legen Sie seine Vorteile gegenüber der
Identifizierung mit Rf - Werten dar! [3 BE] |